
Aux États-Unis et en Union européenne, les exigences réglementaires encadrant le format et le contenu des étiquettes et packagings des produits cosmétiques diffèrent. Dans cet article, nous nous attacherons à mettre en avant les différences fondamentales entre les réglementations des deux côtés de l’Atlantique pour assurer la conformité de vos étiquettes.
Le Règlement Cosmétiques VS le Safe Cosmetics Act
Afin de mieux comprendre les exigences en matière d’étiquetage, commençons par décrire le contexte entourant l’emballage, l’étiquetage et la mise en marché de produits cosmétiques
Réglementation américaine
De façon générale, il existe deux types de lois aux États-Unis : fédérales et locales. Dans cet article nous traiterons principalement les lois fédérales et ne mentionnerons que les législations locales les plus importantes, à savoir la Proposition 65 en Californie, le California Safety Act, la Chemical of High Concern to Children dans l’État de Washington, la Partie I du Chapitre 499 des Florida Satutes et le Wholesale Food and Cosmetic Project dans le New Jersey.
Les produits cosmétiques sont réglementés par la Food and Drugs Administration (FDA) par le biais de différentes lois :
- Le Federal Food Drugs and Cosmetic Act (FD&C) de 1938, tel qu’amendé,
- Le Fair Packaging and Labeling Act.
En 2010, le Safe Cosmetics Act a conféré à la FDA le pouvoir de contrôler les substances chimiques dans les cosmétiques et la possibilité d’interdire les carcinogènes et les perturbateurs endocriniens. Le FD&C Act interdit la mise sur le marché de produits cosmétiques frelatés ou faussement étiquetés pour le commerce entre États. Un nouvel amendement avait été prévu pour 2012 et soutenu par le Républicain Leonard Lance.
La Food and Drugs Administration est également compétente en matière de colorants. Elle a mis en place des directives à l’attention des fabricants pour évaluer la sécurité de leurs produits :
- Identification des dangers
- Évaluation de la relation dose-réponse
- Évaluation de l’exposition
- Caractérisation des risques
Pour atteindre ces objectifs, les entreprises peuvent compter sur :
- Les travaux expérimentaux sur les données toxicologiques disponibles pour des ingrédients similaires sur la formulation d’autres produits,
- Si nécessaire, la réalisation de tests toxicologiques additionnels portant sur l’information disponible.
À l’heure actuelle, aucune réglementation ne couvre les nanomatériaux.
Le FD&C Act comprend également un programme de compte-rendus nommé « Programme d’enregistrement volontaire des cosmétiques » (Voluntary Cosmetic Registration Program – VCRP) pour les fabricants. Le VCRP est divisé en deux parties :
- Enregistrement des entreprises
- • Déclaration des ingrédients des produits cosmétiques
Le Règlement Cosmétique Européen
Le Règlement sur les Produits Cosmétiques de l’Union européenne (Règlement CE no 1223/2009) est entré en vigueur en 2013 et concerne 31 pays européens (les 28 pays de l’Union européenne + Norvège + Islande + Lichtenstein). Il est fondé sur trois principes :
- Sécurité des matières premières et des ingrédients
- Bonnes pratiques de fabrication
- Surveillance du marché des produits cosmétiques
Ces principes se traduisent par des exigences vis-à-vis des marques de cosmétiques telles que (liste non exhaustive) :
- Désigner une Personne Responsable (PR)
- Constituer un Dossier d’Information sur le Produit une évaluation de la sécurité
- Respecter les Bonnes pratiques de Fabrication (BPF) pour les cosmétiques
- Être en conformité avec les exigences liées à l’étiquetage et l’emballage
- Notifier les autorités via le Cosmetic Products Notification Portal (CPNP)
Avec cette réglementation, l’Union européenne impose une transparence accrue sur les produits finis cosmétiques, empêche la mise sur le marché de substances dangereuses et renforce la sécurité du consommateur.
Exigences en matière d’étiquetage : États-Unis VS Europe
L’étiquetage des produits cosmétiques aux États-Unis
Les produits cosmétiques distribués aux États-Unis doivent être conformes au «Cosmetic Labeling Guide» publié par la FDA sous le FD&C Act. Par « étiquetage » on entend toutes les étiquettes ainsi que tout texte, écrit ou imprimé, et toute représentation graphique qui figure sur le produit ou l’accompagne.
Les exigences principales sont :
Panneau principal d’affichage (Principal Display Panel, ou PDP)
- Déclaration d’identité : Nom commun ou courant, descriptif, nom fantaisie, illustration, importance, placement.
- Quantité nette : : Quantity of the contents, in terms of weight, measure, numerical count
- Avertissement : Si le produit cosmétique contient un ingrédient pour lequel une preuve suffisante de sécurité n’a pas été obtenue, un avertissement doit être placé sur le PDP, tel que « Attention — la sécurité de ce produit n’a pas été prouvée »
À noter: Les déclarations sur l’étiquette requises par le FD&C Act doivent apparaître sur le produit comme sur tout contenant ou enveloppe l’accompagnant.
Panneau d’information (Information Panel, ou IP) :
- Langue : Toute étiquette, ou déclaration y figurant, requise par la loi ou la réglementation, doit être en anglais. Si l’étiquette contient également des mentions en langue étrangère, toutes les informations obligatoires doivent aussi apparaître dans cette langue.
- Nom et adresse de l'entreprise : Raison sociale, mentions « fabriqué pour XXX » et « distribué par XXX », adresse, siège social.
- Mention distributeur : Ajouter la mention « fabriqué pour XXX » ou « distribué par XXX » si pertinent.
- Avertissements : Le FD&C Act et les réglementations qui lui sont associées décrivent des mentions d’avertissements spécifiques. Ainsi, les produits cosmétiques pouvant présenter un danger pour les consommateurs doivent afficher les avertissements appropriés sur leur étiquette.
- Déclaration des ingrédients : Les ingrédients doivent figurer clairement et intelligiblement sur l’étiquette, de façon à être comprise par une personne ordinaire dans des conditions normales. La taille du panneau doit être suffisante et celle de la police ne doit pas être inférieur à une certain proportion de la hauteur de ce dernier (1/6 pouces). L’IP doit être clair pour le consommateur, non obscurci ou dissimulé par des éléments de décoration. Si la taille est insuffisante pour contenir toutes les informations, il est autorisé d’utiliser une étiquette, un adhésif ou une carte solidement apposée au produit.
- Nom des ingrédients : Il est permis d’utiliser le nom INCI des ingrédients. Faute de le connaître, il faut utiliser le nom donné par les instances telles que la United States Pharmacopeia, le National Formulary, le Food Chemical Codex, l’USAN et le dictionnaire USP des noms de médicaments.
- Liste des incrédients : Ils doivent être listés en ordre décroissant de prédominance. Sont exemptés de cette règle les ingrédients actifs des médicaments, les ingrédients en concentration inférieure à 1 % et les colorants, qui peuvent donc apparaître dans le désordre. Les parfums et arômes peuvent être listés en ordre décroissant de prédominance comme « parfum » (fragrance) et « arôme » (flavor).
- Informations matérielles : Il est indispensable d’afficher les informations concrètes, ou material facts (par exemple les instructions pour un emploi sûr) ou le produit sera considéré mal étiqueté ou altéré.
Pour plus d’information, vous pouvez consulter le guide complet de l'étiquetage sur le site de la FDA.
Étiquetage et secret commercial
Qu’est-ce qu’un secret commercial ?
"« Le terme secret commercial recouvre toute formule, pratique, dispositif ou information utilisé dans une entreprise et qui fournit à cette dernière une opportunité d’obtenir un avantage sur les concurrents qui ne le connaissent ou ne l’utilisent pas. »
Les produits cosmétiques distribués aux particuliers sont tenus de présenter une liste d’ingrédients, ainsi que le spécifie le Fair Packaging and Labeling Act (FPLA). Cependant, d’après la loi, cette liste ne peut être utilisée pour forcer une entreprise à révéler ses secrets commerciaux.
L’article 21 du « Code of Federal Regulations » (CFR), alinéa 701.3 (a), donne un exemple : Il n’est pas nécessaire de lister individuellement les ingrédients des parfums et des arômes sur les étiquettes des produits cosmétiques, car ce sont les ingrédients les plus susceptibles de faire l’objet d’un secret commercial. En lieu et place, ils peuvent être listés simplement comme “parfum“ ou “arôme“. »
Si vous souhaitez essayer d’obtenir le statut de secret commercial pour votre ingrédient, gardez à l’esprit que la FDA n’a octroyé qu’une seule fois ce statut.
Comment obtenir le statut « secret commercial » ?
Il vous faudra soumettre la déclaration de composition de votre ingrédient ou matière première au « Voluntary Cosmetic Registration Program » (VCRP) de la FDA via le formulaire FDA2512 : « déclaration d’ingrédient de produit cosmétique ».
Les informations à communiquer pour permettre à la FDA d’évaluer votre demande sont tout à la fois de nature légale et technique. Il faut aborder :
- Dans quelle mesure l’ingrédient est connu, en interne dans l’entreprise et en externe et les actions que vous avez entreprises pour protéger cette information, de même que la difficulté de l’identifier ou la dupliquer
- La valeur que possède l’information pour vous ou vos concurrents, s’ils venaient à en prendre connaissance, ainsi que les efforts et dépenses liées au développement et à la conception de l’ingrédient
La FDA promet une réponse provisoire dans les 180 jours.
L’étiquetage des produits cosmétiques en Europe
Les règles encadrant la conformité de l’étiquetage des produits cosmétiques sont définies dans le Règlement EC no 1223/2009.
Voici les mentions obligatoires à faire apparaître en caractères « indélébiles, facilement lisibles et visibles » :
- Nom et adresse de la Personne Responsable : Si votre entreprise est établie en dehors de l’UE, il est obligatoire de désigner une PR pour mettre votre produit sur le marché. Si vous êtes une marque cosmétique basée en UE, vous serez considéré Personne Responsable par défaut, sauf si vous décidez de désigner quelqu’un d’autre.
- Pays d'origine : Ajoutez la mention « Made in XXXX » sauf si le pays est fabriqué en UE, auquel cas ce n’est pas obligatoire. À noter : il n’est pas nécessaire de traduire l’expression « Made in ».
- Contenu nominal: : Le contenu nominal doit apparaître en grammes (g) ou en millilitres (ml) et en première position. Vous pouvez ajouter d’autres unités de mesure si vous le souhaitez (ex : oz).
- Date de durabilité minimale (DMD) & Période après ouverture (PAO) : Si la durabilité est inférieure ou égale à 30 mois, il faut ajouter le symbole « sablier » avec la date (selon le format MMAAAA, MMAA, JJMMAAAA ou JJMMAA). Si au contraire la DOMD est supérieure à 30 mois, il faut indiquer la PAO. Le symbole « récipient ouvert » doit alors apparaître sur l’étiquette avec, à l’intérieur ou à côté, le nombre de mois (M) ou d’années (A).
- Précautions particulières d'utilisation et avertissements: Selon le type de produit cosmétique, certaines précautions particulières d’utilisation et certains avertissements peuvent être utiles aux consommateurs, voire obligatoires dans certains cas.
- Numéro de lot de fabrication : Il est obligatoire, mais aucun format n’est imposé.
- Fonction du produit : Afin d’éviter toute mauvaise utilisation, elle doit être clairement indiquée (ex : crème hydratante pour mains).
- Liste d'ingrédients: Dans l’ordre décroissant de poids, excepté les ingrédients présents à moins de 1 %.
À noter particulièrement :
- Traduction : L’Union européenne est composée de 28 pays. Il y a plus de 24 langues officielles. Vous devez traduire la fonction du produit, les précautions d’utilisation et les avertissements, mais aussi le contenu nominal, dans la langue du pays vers lequel vous exportez. Il est important de préciser que l’Autriche, la Bulgarie, la France, la Pologne, le Portugal et la Slovaquie exigent la traduction complète de l’étiquette, c’est-à-dire y compris les contenus marketing et les allégations.
- Tous les éléments ci-dessus doivent être présents sur les étiquettes. S’il est impossible d’imprimer les informations obligatoires pour des raisons pratiques (ex : pas assez de place car le produit est trop petit), alors il est permis d’utiliser un document joint pour certaines mentions uniquement. Ce document peut être une notice, une étiquette, une bande ou une carte jointe ou attachée au produit. Le cas échéant, l’information contenue sera indiquée sur l’emballage primaire (Primary Packaging, ou PP) et / ou sur l’emballage secondaire (Secondary Packaging, ou SP) par un symbole « livre et main ».
Résumé : les différences clés entre les exigences d’étiquetage aux États-Unis et en Europe
Exemple d’étiquette conforme pour le marché européen

Quels symboles dois-je utiliser ?

Le symbole « sablier » sert à illustrer la Date de Durabilité Minimale (DOMD) lorsque celle-ci est inférieure ou égale à 30 mois. La DOMD est définie grâce au test de stabilité. Il faut ajouter la date à côté du symbole.
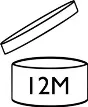
Si la DOMD excède 30 mois, le symbole « récipient ouvert » indique la Période Après Ouverture (PAO) définie par l’association du test de stabilité et du test de simulation.

Le symbole « livre et main » informe le consommateur qu’une notice, étiquette, bande ou carte est jointe au produit et contient des informations réglementaires additionnelles.
Cas pratique : un produit de protection solaire doit-il être étiqueté comme cosmétique ou comme un produit pharmaceutique ?
Réponse : cela dépend du marché considéré.
En UE, une crème solaire correspond à la définition d’un produit cosmétique selon le Règlement EC n°1223/2009. À l’inverse, aux États-Unis, la FDA considère les écrans solaires comme des « over the counter (OTC) drugs », soit des médicaments qu’il est possible, en tant que consommateur d’acheter sans posséder d’ordonnance. De fait, les fabricants doivent se mettre en conformité avec les deux réglementations : FD&C Act et réglementation pharmaceutique ! De plus, les allégations sont restreintes et l’étiquetage est alors soumis à des règles différentes — il faut notamment informer le consommateur des ingrédients actifs contenus dans le produit).
Quand les consommateurs voient le terme « écran solaire » ou autre terminologie similaire liée à la protection solaire sur l’étiquette d’un produit, ils s’attendent à ce que le produit les protège, d’une manière ou d’une autre, des effets néfastes du soleil, quelles que soient les autres mentions présentes.
Par conséquent, l’utilisation du terme “écran solaire” ou autre terminologie similaire liée à la protection solaire sur l’étiquette d’un produit a généralement pour effet de soumettre ce dernier à la réglementation des produits pharmaceutiques.
Source : Consignes d’étiquetage des produits cosmétiques de la FDA
La FDA fournit notamment un guide pour mieux comprendre ce cas particulier (schéma en anglais) :

certains produits cosmétiques restent difficiles à classifier. Pour plus d'information à ce sujet vous pouvez consulter notre article sur les "produits cosmétiques frontière"
Vous souhaitez en savoir plus sur l'étiquetage de vos produits cosmétiques ?
Pour en savoir plus, n'hésitez pas à contacter nos experts.
Aux États-Unis et en Union européenne, les exigences réglementaires encadrant le format et le contenu des étiquettes et packagings des produits cosmétiques diffèrent. Dans cet article, nous nous attacherons à mettre en avant les différences fondamentales entre les réglementations des deux côtés de l’Atlantique pour assurer la conformité de vos étiquettes.
Le Règlement Cosmétiques VS le Safe Cosmetics Act
Afin de mieux comprendre les exigences en matière d’étiquetage, commençons par décrire le contexte entourant l’emballage, l’étiquetage et la mise en marché de produits cosmétiques
Réglementation américaine
De façon générale, il existe deux types de lois aux États-Unis : fédérales et locales. Dans cet article nous traiterons principalement les lois fédérales et ne mentionnerons que les législations locales les plus importantes, à savoir la Proposition 65 en Californie, le California Safety Act, la Chemical of High Concern to Children dans l’État de Washington, la Partie I du Chapitre 499 des Florida Satutes et le Wholesale Food and Cosmetic Project dans le New Jersey.
Les produits cosmétiques sont réglementés par la Food and Drugs Administration (FDA) par le biais de différentes lois :
- Le Federal Food Drugs and Cosmetic Act (FD&C) de 1938, tel qu’amendé,
- Le Fair Packaging and Labeling Act.
En 2010, le Safe Cosmetics Act a conféré à la FDA le pouvoir de contrôler les substances chimiques dans les cosmétiques et la possibilité d’interdire les carcinogènes et les perturbateurs endocriniens. Le FD&C Act interdit la mise sur le marché de produits cosmétiques frelatés ou faussement étiquetés pour le commerce entre États. Un nouvel amendement avait été prévu pour 2012 et soutenu par le Républicain Leonard Lance.
La Food and Drugs Administration est également compétente en matière de colorants. Elle a mis en place des directives à l’attention des fabricants pour évaluer la sécurité de leurs produits :
- Identification des dangers
- Évaluation de la relation dose-réponse
- Évaluation de l’exposition
- Caractérisation des risques
Pour atteindre ces objectifs, les entreprises peuvent compter sur :
- Les travaux expérimentaux sur les données toxicologiques disponibles pour des ingrédients similaires sur la formulation d’autres produits,
- Si nécessaire, la réalisation de tests toxicologiques additionnels portant sur l’information disponible.
À l’heure actuelle, aucune réglementation ne couvre les nanomatériaux.
Le FD&C Act comprend également un programme de compte-rendus nommé « Programme d’enregistrement volontaire des cosmétiques » (Voluntary Cosmetic Registration Program – VCRP) pour les fabricants. Le VCRP est divisé en deux parties :
- Enregistrement des entreprises
- • Déclaration des ingrédients des produits cosmétiques
Le Règlement Cosmétique Européen
Le Règlement sur les Produits Cosmétiques de l’Union européenne (Règlement CE no 1223/2009) est entré en vigueur en 2013 et concerne 31 pays européens (les 28 pays de l’Union européenne + Norvège + Islande + Lichtenstein). Il est fondé sur trois principes :
- Sécurité des matières premières et des ingrédients
- Bonnes pratiques de fabrication
- Surveillance du marché des produits cosmétiques
Ces principes se traduisent par des exigences vis-à-vis des marques de cosmétiques telles que (liste non exhaustive) :
- Désigner une Personne Responsable (PR)
- Constituer un Dossier d’Information sur le Produit une évaluation de la sécurité
- Respecter les Bonnes pratiques de Fabrication (BPF) pour les cosmétiques
- Être en conformité avec les exigences liées à l’étiquetage et l’emballage
- Notifier les autorités via le Cosmetic Products Notification Portal (CPNP)
Avec cette réglementation, l’Union européenne impose une transparence accrue sur les produits finis cosmétiques, empêche la mise sur le marché de substances dangereuses et renforce la sécurité du consommateur.
Exigences en matière d’étiquetage : États-Unis VS Europe
L’étiquetage des produits cosmétiques aux États-Unis
Les produits cosmétiques distribués aux États-Unis doivent être conformes au «Cosmetic Labeling Guide» publié par la FDA sous le FD&C Act. Par « étiquetage » on entend toutes les étiquettes ainsi que tout texte, écrit ou imprimé, et toute représentation graphique qui figure sur le produit ou l’accompagne.
Les exigences principales sont :
Panneau principal d’affichage (Principal Display Panel, ou PDP)
- Déclaration d’identité : Nom commun ou courant, descriptif, nom fantaisie, illustration, importance, placement.
- Quantité nette : : Quantity of the contents, in terms of weight, measure, numerical count
- Avertissement : Si le produit cosmétique contient un ingrédient pour lequel une preuve suffisante de sécurité n’a pas été obtenue, un avertissement doit être placé sur le PDP, tel que « Attention — la sécurité de ce produit n’a pas été prouvée »
À noter: Les déclarations sur l’étiquette requises par le FD&C Act doivent apparaître sur le produit comme sur tout contenant ou enveloppe l’accompagnant.
Panneau d’information (Information Panel, ou IP) :
- Langue : Toute étiquette, ou déclaration y figurant, requise par la loi ou la réglementation, doit être en anglais. Si l’étiquette contient également des mentions en langue étrangère, toutes les informations obligatoires doivent aussi apparaître dans cette langue.
- Nom et adresse de l'entreprise : Raison sociale, mentions « fabriqué pour XXX » et « distribué par XXX », adresse, siège social.
- Mention distributeur : Ajouter la mention « fabriqué pour XXX » ou « distribué par XXX » si pertinent.
- Avertissements : Le FD&C Act et les réglementations qui lui sont associées décrivent des mentions d’avertissements spécifiques. Ainsi, les produits cosmétiques pouvant présenter un danger pour les consommateurs doivent afficher les avertissements appropriés sur leur étiquette.
- Déclaration des ingrédients : Les ingrédients doivent figurer clairement et intelligiblement sur l’étiquette, de façon à être comprise par une personne ordinaire dans des conditions normales. La taille du panneau doit être suffisante et celle de la police ne doit pas être inférieur à une certain proportion de la hauteur de ce dernier (1/6 pouces). L’IP doit être clair pour le consommateur, non obscurci ou dissimulé par des éléments de décoration. Si la taille est insuffisante pour contenir toutes les informations, il est autorisé d’utiliser une étiquette, un adhésif ou une carte solidement apposée au produit.
- Nom des ingrédients : Il est permis d’utiliser le nom INCI des ingrédients. Faute de le connaître, il faut utiliser le nom donné par les instances telles que la United States Pharmacopeia, le National Formulary, le Food Chemical Codex, l’USAN et le dictionnaire USP des noms de médicaments.
- Liste des incrédients : Ils doivent être listés en ordre décroissant de prédominance. Sont exemptés de cette règle les ingrédients actifs des médicaments, les ingrédients en concentration inférieure à 1 % et les colorants, qui peuvent donc apparaître dans le désordre. Les parfums et arômes peuvent être listés en ordre décroissant de prédominance comme « parfum » (fragrance) et « arôme » (flavor).
- Informations matérielles : Il est indispensable d’afficher les informations concrètes, ou material facts (par exemple les instructions pour un emploi sûr) ou le produit sera considéré mal étiqueté ou altéré.
Pour plus d’information, vous pouvez consulter le guide complet de l'étiquetage sur le site de la FDA.
Étiquetage et secret commercial
Qu’est-ce qu’un secret commercial ?
"« Le terme secret commercial recouvre toute formule, pratique, dispositif ou information utilisé dans une entreprise et qui fournit à cette dernière une opportunité d’obtenir un avantage sur les concurrents qui ne le connaissent ou ne l’utilisent pas. »
Les produits cosmétiques distribués aux particuliers sont tenus de présenter une liste d’ingrédients, ainsi que le spécifie le Fair Packaging and Labeling Act (FPLA). Cependant, d’après la loi, cette liste ne peut être utilisée pour forcer une entreprise à révéler ses secrets commerciaux.
L’article 21 du « Code of Federal Regulations » (CFR), alinéa 701.3 (a), donne un exemple : Il n’est pas nécessaire de lister individuellement les ingrédients des parfums et des arômes sur les étiquettes des produits cosmétiques, car ce sont les ingrédients les plus susceptibles de faire l’objet d’un secret commercial. En lieu et place, ils peuvent être listés simplement comme “parfum“ ou “arôme“. »
Si vous souhaitez essayer d’obtenir le statut de secret commercial pour votre ingrédient, gardez à l’esprit que la FDA n’a octroyé qu’une seule fois ce statut.
Comment obtenir le statut « secret commercial » ?
Il vous faudra soumettre la déclaration de composition de votre ingrédient ou matière première au « Voluntary Cosmetic Registration Program » (VCRP) de la FDA via le formulaire FDA2512 : « déclaration d’ingrédient de produit cosmétique ».
Les informations à communiquer pour permettre à la FDA d’évaluer votre demande sont tout à la fois de nature légale et technique. Il faut aborder :
- Dans quelle mesure l’ingrédient est connu, en interne dans l’entreprise et en externe et les actions que vous avez entreprises pour protéger cette information, de même que la difficulté de l’identifier ou la dupliquer
- La valeur que possède l’information pour vous ou vos concurrents, s’ils venaient à en prendre connaissance, ainsi que les efforts et dépenses liées au développement et à la conception de l’ingrédient
La FDA promet une réponse provisoire dans les 180 jours.
L’étiquetage des produits cosmétiques en Europe
Les règles encadrant la conformité de l’étiquetage des produits cosmétiques sont définies dans le Règlement EC no 1223/2009.
Voici les mentions obligatoires à faire apparaître en caractères « indélébiles, facilement lisibles et visibles » :
- Nom et adresse de la Personne Responsable : Si votre entreprise est établie en dehors de l’UE, il est obligatoire de désigner une PR pour mettre votre produit sur le marché. Si vous êtes une marque cosmétique basée en UE, vous serez considéré Personne Responsable par défaut, sauf si vous décidez de désigner quelqu’un d’autre.
- Pays d'origine : Ajoutez la mention « Made in XXXX » sauf si le pays est fabriqué en UE, auquel cas ce n’est pas obligatoire. À noter : il n’est pas nécessaire de traduire l’expression « Made in ».
- Contenu nominal: : Le contenu nominal doit apparaître en grammes (g) ou en millilitres (ml) et en première position. Vous pouvez ajouter d’autres unités de mesure si vous le souhaitez (ex : oz).
- Date de durabilité minimale (DMD) & Période après ouverture (PAO) : Si la durabilité est inférieure ou égale à 30 mois, il faut ajouter le symbole « sablier » avec la date (selon le format MMAAAA, MMAA, JJMMAAAA ou JJMMAA). Si au contraire la DOMD est supérieure à 30 mois, il faut indiquer la PAO. Le symbole « récipient ouvert » doit alors apparaître sur l’étiquette avec, à l’intérieur ou à côté, le nombre de mois (M) ou d’années (A).
- Précautions particulières d'utilisation et avertissements: Selon le type de produit cosmétique, certaines précautions particulières d’utilisation et certains avertissements peuvent être utiles aux consommateurs, voire obligatoires dans certains cas.
- Numéro de lot de fabrication : Il est obligatoire, mais aucun format n’est imposé.
- Fonction du produit : Afin d’éviter toute mauvaise utilisation, elle doit être clairement indiquée (ex : crème hydratante pour mains).
- Liste d'ingrédients: Dans l’ordre décroissant de poids, excepté les ingrédients présents à moins de 1 %.
À noter particulièrement :
- Traduction : L’Union européenne est composée de 28 pays. Il y a plus de 24 langues officielles. Vous devez traduire la fonction du produit, les précautions d’utilisation et les avertissements, mais aussi le contenu nominal, dans la langue du pays vers lequel vous exportez. Il est important de préciser que l’Autriche, la Bulgarie, la France, la Pologne, le Portugal et la Slovaquie exigent la traduction complète de l’étiquette, c’est-à-dire y compris les contenus marketing et les allégations.
- Tous les éléments ci-dessus doivent être présents sur les étiquettes. S’il est impossible d’imprimer les informations obligatoires pour des raisons pratiques (ex : pas assez de place car le produit est trop petit), alors il est permis d’utiliser un document joint pour certaines mentions uniquement. Ce document peut être une notice, une étiquette, une bande ou une carte jointe ou attachée au produit. Le cas échéant, l’information contenue sera indiquée sur l’emballage primaire (Primary Packaging, ou PP) et / ou sur l’emballage secondaire (Secondary Packaging, ou SP) par un symbole « livre et main ».
Résumé : les différences clés entre les exigences d’étiquetage aux États-Unis et en Europe
Exemple d’étiquette conforme pour le marché européen

Quels symboles dois-je utiliser ?

Le symbole « sablier » sert à illustrer la Date de Durabilité Minimale (DOMD) lorsque celle-ci est inférieure ou égale à 30 mois. La DOMD est définie grâce au test de stabilité. Il faut ajouter la date à côté du symbole.

Si la DOMD excède 30 mois, le symbole « récipient ouvert » indique la Période Après Ouverture (PAO) définie par l’association du test de stabilité et du test de simulation.

Le symbole « livre et main » informe le consommateur qu’une notice, étiquette, bande ou carte est jointe au produit et contient des informations réglementaires additionnelles.
Cas pratique : un produit de protection solaire doit-il être étiqueté comme cosmétique ou comme un produit pharmaceutique ?
Réponse : cela dépend du marché considéré.
En UE, une crème solaire correspond à la définition d’un produit cosmétique selon le Règlement EC n°1223/2009. À l’inverse, aux États-Unis, la FDA considère les écrans solaires comme des « over the counter (OTC) drugs », soit des médicaments qu’il est possible, en tant que consommateur d’acheter sans posséder d’ordonnance. De fait, les fabricants doivent se mettre en conformité avec les deux réglementations : FD&C Act et réglementation pharmaceutique ! De plus, les allégations sont restreintes et l’étiquetage est alors soumis à des règles différentes — il faut notamment informer le consommateur des ingrédients actifs contenus dans le produit).
Quand les consommateurs voient le terme « écran solaire » ou autre terminologie similaire liée à la protection solaire sur l’étiquette d’un produit, ils s’attendent à ce que le produit les protège, d’une manière ou d’une autre, des effets néfastes du soleil, quelles que soient les autres mentions présentes.
Par conséquent, l’utilisation du terme “écran solaire” ou autre terminologie similaire liée à la protection solaire sur l’étiquette d’un produit a généralement pour effet de soumettre ce dernier à la réglementation des produits pharmaceutiques.
Source : Consignes d’étiquetage des produits cosmétiques de la FDA
La FDA fournit notamment un guide pour mieux comprendre ce cas particulier (schéma en anglais) :

certains produits cosmétiques restent difficiles à classifier. Pour plus d'information à ce sujet vous pouvez consulter notre article sur les "produits cosmétiques frontière"
Vous souhaitez en savoir plus sur l'étiquetage de vos produits cosmétiques ?
Pour en savoir plus, n'hésitez pas à contacter nos experts.




.png)


